
Выставка Стоматология Беларуси 2025
03.11.2025

27-я Азербайджанская Международная Выставка «Медицинские Инновации» Medinex 2025
03.11.2025

День открытых дверей для специалистов здравоохранения, проходящих повышение квалификации
17.10.2025

Сотрудники «АКАДЕМФАРМ» отмечены благодарностью от Центра экспертиз и испытаний в здравоохранении Республики Беларусь
17.10.2025

АКАДЕМФАРМ открыл свои двери для партнеров: состоялась экскурсия для аптечной сети «Искамед»
19.09.2025

Поставка «Rivaxan» в Национальную систему здравоохранения Республики Куба
04.08.2025

Первая партия «Rivaxan» произведена на Кубе
25.07.2025
Королева А.А.1, Журавков Ю.Л.2
1Белорусская медицинская академия последипломного образования, Минск
2Белорусский государственный медицинский университет, Минск
Koroleva А.А.1, Zhuravkov Y.L.2
1Belarusian Medical Academy for Post-Graduate Education, Minsk
2Belarusian State Medical University, Minsk
Efficacy and safety of sartans in clinical practice
Резюме. В многочисленных исследованиях показаны протективное действие и плейотропные эффекты сартанов у пациентов с артериальной гипертензией. Основываясь на результатах рандомизированных клинических исследований сартанов, мы выделили клинические ситуации, в которых назначение того или иного препарата предпочтительно. Так, для пациентов с множественными факторами риска развития сердечно-сосудистых осложнений препарат выбора – телмисартан, при нефропатии – ирбесартан и кандесартан, перенесшим острый инфаркт миокарда – валсартан, а при хронической сердечной недостаточности с низкой фракцией выброса – лозартан, валсартан и кандесартан.
Ключевые слова: сартаны, рандомизированные клинические исследования, множественные факторы риска развития сердечно-сосудистых осложнений.
Медицинские новости. – 2021. – No7. – С. 22–27.
Summary. Numerous studies have shown the protective and pleiotropic effects of sartans in patients with arterial hypertension. Basing on results of analysis of randomized clinical trials of sartans we have outlined clinical situations in which prescription of one or another drug from this group is preferable. For patients with multiple risk factors of cardiovascular complications preferable agent is telmisartan, for patients with nephropathy– irbesartan and candesartan, for survivors of acute myocardial infarction– valsartan, while for patients with chronic heart failure with low ejection fraction– losartan, valsartan, and candesartan.
Keywords: sartans, randomized clinical trials, multiple risk factors of cardiovascular complications.
Meditsinskie novosti. – 2021. – N7. – P. 22–27.
Cартаны применяются в клинической практике со второй половины 90-х годов прошлого столетия и первое время были в тени хорошо изученных ингибиторов ангиотензинпревращающего фермента (иАПФ). Но за достаточно короткий срок выявлены многочисленные органопротективные свойства представителей этой группы, и показания для их применения значительно расширились.
Сартаны эффективно вмешиваются в неблагоприятное течение событий для пациента, которое мы называем сердечно-сосудистый континуум (рис. 1). Впервые эта концепция была предложена V. Dzau и E. Braunwald в 1991 году, а сегодня является общепризнанной. Начинается эта «печальная дорога» с традиционно известных и кажущихся почти безобидными факторов риска (артериальная гипертензия, нарушения углеводного и липидного обменов, избыточный вес и вредные привычки), пациенты им часто не уделяют должного внимания. Эти факторы, постепенно повреждая эндотелий, в конечном итоге приводят к атеросклерозу, нарушению гемодинамики, ремоделированию миокарда с последующим развитием хронической сердечной недостаточности (ХСН) или инсульта и в дальнейшем – смерти. В основе прогрессирования этих патологических процессов лежит, в первую очередь, гиперактивация ренин-ангиотензин-альдостероновой системы (РААС). При длительной активации эта система вместо выполнения защитной функции превращается в звено патогенеза большого количества заболеваний.
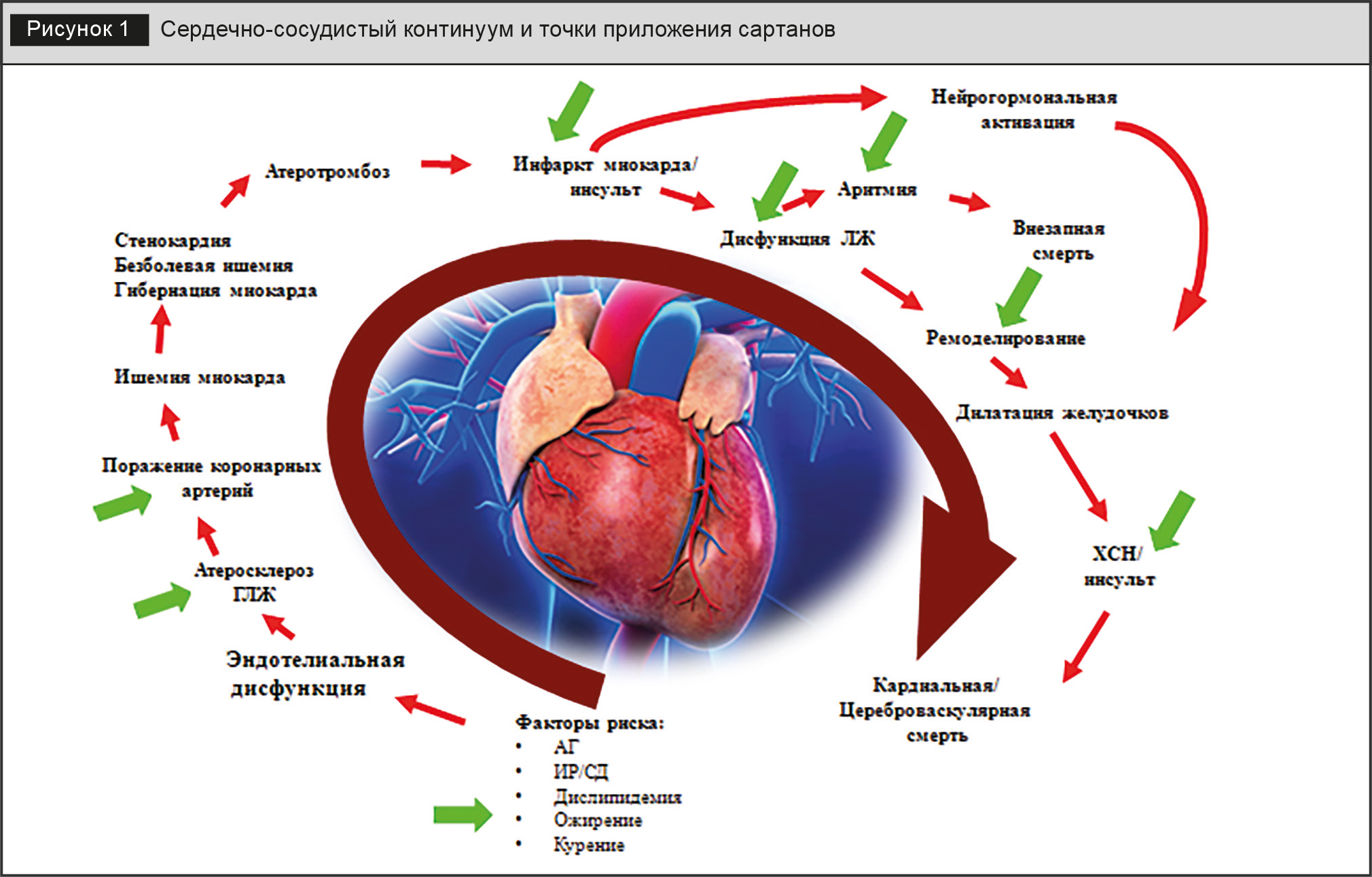
Ведущий медиатор РААС – ангиотензин II (АТ-II), физиологические эффекты которого реализуются на клеточном уровне через ангиотензиновые рецепторы. У человека идентифицированы несколько типов мембраносвязанных, сопряженных с G-белком рецепторов АТ-II, но наиболее полно изучены два подтипа – ATR1 и ATR2.
АТ-II является мощным вазоконстриктором, что приводит в первую очередь к артериальной вазоконстрикции, в том числе артериол почечных клубочков, активации симпато-адреналовой системы, усилению высвобождения норадреналина, вазопрессина, эндотелина-1, реабсорбции натрия и воды, увеличению секреции альдостерона корой надпочечников, повышению артериального давления (АД), гипертрофии кардиомиоцитов и гладкомышечных клеток сосудов, пролиферации фибробластов, активизации синтеза и накопления коллагена, гликозоаминогликанов, эластина, что приводит к развитию гипертрофии и ремоделированию миокарда и сосудистой стенки. АТ-II является медиатором воспаления, способствует адгезии клеточных элементов крови, агрегации тромбоцитов и тромбообразованию. Эти патофизиологические эффекты опосредованы через взаимодействие АТ-II с ATR1.
С другой стороны, стимуляция АТ-II рецепторов 2-го типа вызывает противоположные эффекты, а именно вазодилатацию, подавление пролиферации гладкомышечных и эндотелиальных клеток сосудов, уменьшение гипертрофии кардиомиоцитов и увеличение продукции оксида азота. После открытия специфических рецепторов АТ-II в результате целенаправленного поиска в 1986 году был синтезирован лозартан – первый непептидный селективный антагонист ATR1. В последующем в результате модификации молекулы прототипа были получены еще семь представителей нового класса препаратов, который назвали блокаторами ангиотензиновых рецепторов (БРА). Различия в химической структуре этих препаратов отразились на основных фармакологических свойствах: биодоступность, липофильность, период полувыведения, особенности биотрансформации и пути выведения.
С точки зрения клинической фармакологии, данные препараты не являются истинными антагонистами рецепторов АТ-II, а обратные агонисты, поэтому в последнее время эту группу называют «сартаны». При этом истинные обратные агонисты – лозартан и эпросартан – обратимо связываются с ATR1 и относятся к конкурентным антагонистам (то есть при определенных условиях, например, при повышении уровня АТ-II в ответ на уменьшение объема циркулирующей крови, могут вытесняться из мест связывания), что может приводить к развитию «эффекта ускользания». Кандесартан, валсартан, ирбесартан, телмисартан, а также активный метаболит лозартана EXP3174 действуют как неконкурентные антагонисты и связываются с рецепторами необратимо. Все сартаны связываются с ATR1 в десятки тысяч раз cильнее, чем с ATR2, поэтому не препятствуют активации последних.
Некоторые сартаны препятствуют развитию неблагоприятных эффектов АТ-II не только за счет непосредственного взаимодействия с рецепторами, но и за счет изменения экспрессии гена ATR1. Этот эффект, в частности, присущ телмисартану, обеспечивая более полную блокаду РААС.
В таблице 1 перечислены фармакокинетические характеристики сартанов, включая период полувыведения, Tmax, биодоступность, объем распределения, путь выведения и участие в метаболизме цитохрома P450 [1].
ТАБЛИЦА 1 Фармакологическая характеристика сартанов
| Лекарственное средство |
Доза, мг | T1/2, ч | Tmaх, ч | F, % | Влияние пищи |
Vd, л | Пути выведения, печень/ почки |
CYP метаболизм |
| Лозартан | 25–100 | 2 | 1–1,5 | 33% | да | 34/12 | 60/35 | 2C9, 3A4 |
| Валсартан | 80–320 | 6 | 2–4 | 23–50% | да | 16–17 | 83/13 | 2C9 |
| Кандесартана цилекситил |
8–32 | 9 | 2–5 | 42% | – | 9,1 | 67/33 | 2C9 |
| Телмисартан | 40–80 | 24 | 0,5–1 | 43% | – | 500 | >97/<1 | нет |
| Ирбесартан | 75–300 | 11–15 | 1,3–3 | 60–80% | – | 53–93 | 80/20 | 2C9, 3A4 |
| Эпросартан | 400–800 | 5–9 | 1–3 | 63% | да | 13 | 90/7 | нет |
| Олмесартана медоксомил |
20–40 | 12–14 | 1,7–2,5 | 26% | – | 17,1 | 50–65/35–50 | нет |
| Азилсартана медоксомил |
20 | 12 | 1,5–3 | 60% | – | 16 | 55/42 | 2C9, CYP2B6 CYP2C8 |
П р и м е ч а н и е : F – биодоступность, Tmax – время до достижения максимальной концентрации в плазме, Vd – объем распределения.
Лозартан подвергается метаболизму первого прохождения в печени через систему цитохрома P450 с образованием активного метаболита EXP3174, который в 10–40 раз более эффективен, чем исходная молекула. Кандесартан цилексетил, олмесартан медоксомил, азилсартан медоксомил являются пролекарствами и становятся активными после ряда метаболических превращений в печени. Телмисартан, эпросартан, валсартан и ирбесартан – активные лекарства, поэтому их активность не зависит от состояния печени пациента. Хотя пища влияет на всасывание лозартана, валсартана и эпросартана, это не имеет существенного клинического значения. Наиболее значимо уменьшается абсорбция при приеме с пищей валсартана (площадь под фармакокинетической кривой – AUC – уменьшается на 40–48%), но при этом примерно через 8 часов после приема концентрации валсартана в плазме одинаковы у пациентов, принимавших его с пищей и натощак, поэтому уменьшение AUC не сопровождается клинически значимым снижением эффекта.
У пациентов с тяжелой печеночной недостаточностью необходимо уменьшить вдвое дозу лозартана и рекомендуется соблюдать осторожность при назначении олмесартана.
Уникальный фармакокинетический профиль у телмисартана. У него самый длительный период полувыведения (24 часа), это обеспечивает преимущества в адекватном контроле утреннего подъема АД и, как следствие, уменьшение риска сердечно-сосудистых осложнений. При этом для препарата характерно быстрое начало действия, примерно через 0,5–1,0 часа после приема, пища не влияет на всасывание. У телмисартана самый высокий процент остаточного гипотензивного эффекта, то есть отношение остаточной активности к пиковой (почти 100%). При его использовании один раз в сутки клинически значимое снижение остаточного АД сравнимо со снижением АД на пике действия. Эти свойства делают телмисартан препаратом выбора для «забывчивых» пациентов.
Телмисартан – самый липофильный сартан, у него самый большой объем распределения (500 л), что обеспечивает способность легко проникать в ткани и вызывать блокаду не только плазменной, но и тканевой РААС, обеспечивая выраженные органопротективные свойства. Менее 1% препарата выводится с мочой, поэтому коррекция дозы при нарушении функции почек не требуется. Телмисартан не подвергается метаболизму при участии цитохрома Р450, а значит не вступает во взаимодействие со многими препаратами и является препаратом выбора для пациентов с полифармакотерапией.
Наибольшую аффинность к CYP2C9 среди сартанов имеет лозартан, в меньшей степени – ирбесартан, кандесартан. Любые ингибиторы или индукторы фермента CYP2C9 могут влиять на эффективность лозартана и должны учитываться при выборе препарата.
Длительное использование сартанов в клинической практике и широкое исследование их на лабораторных моделях позволили выявить новые грани этих препаратов. Сегодня мы знаем, что не все эффекты представителей данного класса связаны с влиянием на ATR. Некоторые сартаны способны стимулировать или блокировать и другие рецепторы: PPAR-γ, PPAR-δ, VDR (частичный агонизм), рианодиновые рецепторы, CCR-2b (антагонизм), что обусловливает в первую очередь метаболические эффекты. У отдельных представителей этого класса выявлены гипогликемический, гипоурикемический, гиполипидемический, противовоспалительный, антипролиферативный, антиоксидантный и антиагрегантный эффекты.
PPAR-γ рецепторы (рецепторы, активируемые пролифераторами пероксисом (peroxisome proliferator-activated receptors)) играют ключевую роль в дифференцировке жировой ткани и ее функционировании (рис. 2). PPAR-γ участвуют в дифференцировке адипоцитов и регуляции метаболизма глюкозы, повышая чувствительность к инсулину, и выполняют роль связующего звена в метаболизме жиров и углеводов. Адипонектин – ключевой регулятор этих процессов, обеспечивая через свои рецепторы процессы деремоделирования. Экспрессия и секреция адипонектина стимулируются селективными модуляторами рецепторов, активирующих PPAR-γ.
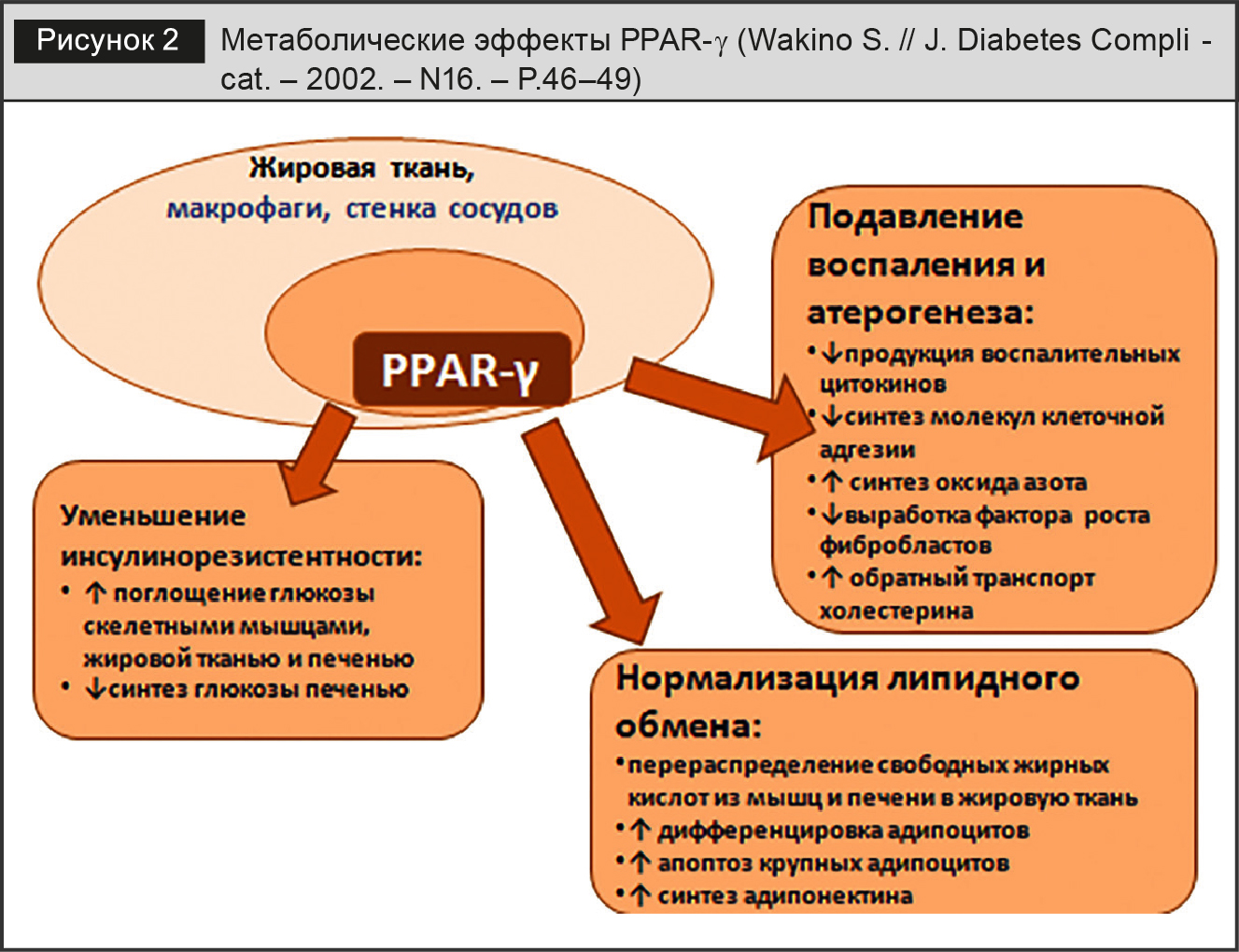
В печени, жировой ткани и мышцах активация PPAR-γ вызывает сахароснижающее и антиатеросклеротическое действие за счет снижения синтеза глюкозы, триглицеридов, инсулинорезистентности и повышения уровня липопротеидов высокой плотности.
Стимуляция PPAR-γ в лейкоцитах оказывает противовоспалительный эффект за счет блокады синтеза цитокинов, хемокинов, молекул адгезии. Кроме этого, активация PPAR-γ обусловливает антиоксидантный и антипролиферативный эффекты. Телмисартан дозозависимо подавляет продукцию активных радикалов, тормозит миграцию Т-лимфоцитов в стенку сосудов и восстанавливает функцию митохондрий. Препарат тормозит пролиферацию гладкомышечных клеток аорты и фибробластов сердца до 50–70%.
Рассматривают два возможных механизма влияния сартанов на PPAR-γ. Во-первых, селективная блокада АТR1 приводит к стимуляции АТR2 и PPAR-γ. Во-вторых, предполагают, что препарат может проникать через мембрану клетки и ядра, связываться непосредственно с PPAR-γ. Не все сартаны могут активировать PPAR-γ. У телмисартана самое высокое сродство PPAR-γ (> лозартан > олмесартан > ирбесартан > валсартан > кандесартан). Он также увеличивает экспрессию PPAR-γ.
Сартаны влияют также на PPAR-δ, которые представлены в поджелудочной железе, печени, почках и ткани мозга и участвуют в регуляции работы митохондрий. Стимуляция этих рецепторов в поджелудочной железе приводит к увеличению экспрессии дыхательной цепи митохондрий и глюкозостимулированной секреции инсулина, в нейронах уменьшается дисфункция митохондрий и повышается выживаемость нейронов, в почках снижаются пролиферативные процессы и развитие фиброза. Телмисартан по сравнению с другими сартанами имеет преимущество в этих эффектах.
Такие уникальные свойства телмисартана обеспечивают плеотропные эффекты, главными из которых являются снижение инсулинорезистентности, повышение уровня адипонектина, улучшение функциональной активности эндотелия, ангио- и ренопротективные эффекты, способность обеспечивать регресс гипертрофии миокарда левого желудочка. Доказанная способность телмисартана (ONTARGET, TRANSCEND) влиять на прогноз улиц высокого сердечно-сосудистого риска делает его препаратом выбора у этой категории пациентов.
По данным исследований, применение сартанов сопровождается наименьшим риском развития новых случаев диабета (Eliot и соавт., 2007). Это же было подтверждено в исследованиях LIFE (на 25%), SCOPE (на 20%) иCHARM (на 22%).
Повышение уровня мочевой кислоты, которая является конечным продуктом пуринового обмена, – независимый фактор сердечно-сосудистого риска прогрессирования нефропатии и развития артериальной гипертензии (АГ) у подростков. Сартаны снижают уровень мочевой кислоты, блокируя реабсорбцию в проксимальных канальцах почек. Очень важно, что урикозурический эффект лозартана и валсартана сохраняется и при их комбинации с диуретиками, благодаря чему предупреждается вызываемое диуретиками повышение уровня мочевой кислоты в крови. Лучший эффект по снижению уровня мочевой кислоты дают лозартан, затем валсартан, ирбесартан и кандесартан (олмесартан и азилсартан не влияют). Кроме этого, лозартан и телмисартан за счет блокады тромбоксана А2 обладают антиагрегантным эффектом.
Противовоспалительная активность сартанов реализуется и через блокаду хемокиновых рецепторов. Этот эффект присущ олмесартану и ирбесартану.
Если сравнивать противовоспалительную активность, обусловленную блокадой АТR1, то этот эффект наиболее выражен у олмесартана, в меньшей степени – у телмисартана, валсартана и лозартана. Применение данных сартанов у пациентов с аутоиммунными заболеваниями вызывает улучшение течения основного заболевания.
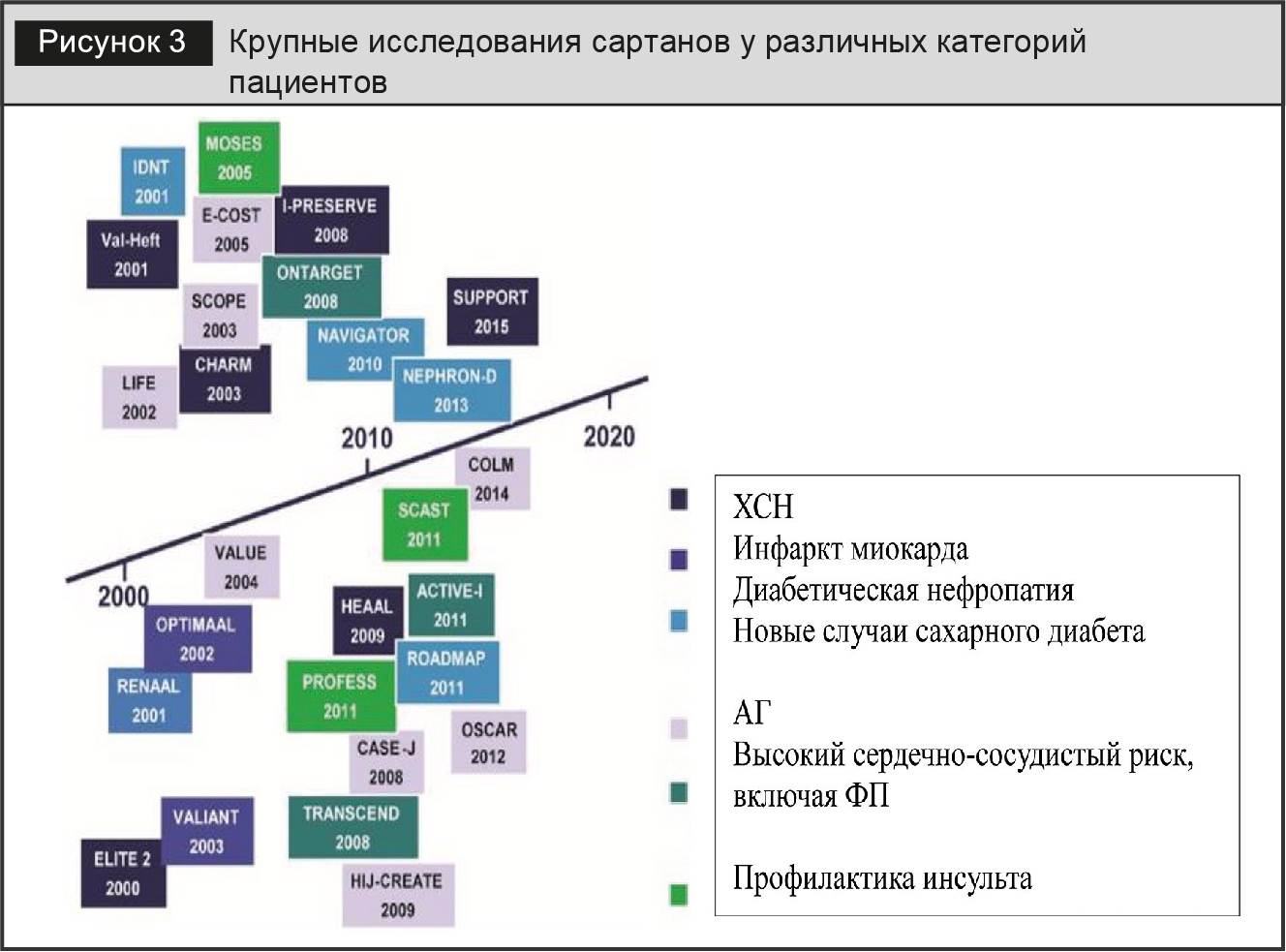
Эффективность и безопасность сартанов хорошо изучена в многочисленных рандомизированных клинических исследованиях. На рисунке 3 представлены крупные исследования сартанов [2], в которых принимало участие суммарно более 161 000 пациентов.
Антигипертензивные эффекты сартанов
Сартаны по своей способности снижать АД не уступают другим классам антигипертензивных лекарственных средств и являются препаратами первого ряда наряду с иАПФ в лечении АГ. В большинстве рандомизированных контролируемых крупных исследований было выявлено, что они не только не уступают, но часто превосходят другие препараты сравнения. Так, в исследованиях LIFE (лозартан) и MOSES (эпросартан) при АГ сартаны превосходили β-адреноблокаторы и антагонисты кальция соответственно [3, 4]. В исследованиях RENAAL (лозартан), IDNT и IRMA (ирбесартан), ROADMAP (олмесартан)
сартаны показали преимущество по сравнению с традиционной оптимальной терапией [5–8]. В исследовании ONTARGET (телмисартан) у пациентов высокого риска сартаны по эффективности были сравнимы с иАПФ. В этом исследовании телмисартан не уступал рамиприлу – «золотому стандарту» у пациентов высокого риска – в предотвращении риска сердечно-сосудистой смерти, инфаркта миокарда, инсульта и госпитализации по поводу сердечной недостаточности, при этом эффект не зависел от степени снижения АД [9]. Во всех этих исследованиях сартаны продемонстрировали лучшую переносимость, безопасность и комплаентность пациентов.
Был выполнен целый ряд исследований для сравнения антигипертензивного эффекта представителей этой группы между собой. В исследовании CLAIM [10] показано, что кандесартан в дозах 16 и 32 мг/сутки более эффективен, чем лозартан в суточных дозах 50 и 100 мг соответственно. Кандесартан в дозе 16 мг/сутки в большей степени снижает АД, чем лозартан 100 мг/сутки.
В крупном мета-анализе R. Nixon и соавт. (2009), включавшем 31 исследование с участием 13 110 пациентов, проводилось сравнение гипотензивной эффективности 6 сартанов [11]. Был показан дозозависимый эффект препаратов этой группы и наиболее выраженное снижение АД на фоне применения кандесартана.
Более детальный сравнительный анализ эффективности сартанов выполнен в Кохрейновском мета-анализе В. Негап и соавт. [12]. Оценивалась степень снижения АД для различных дозировок: 1/4 максимальной дозы, 1/2 и максимальная доза. Анализ показал дозозависимый гипотензивный эффект сартанов. Наиболее выраженное снижение АД было при применении кандесартана. Но в этом анализе не участвовал азилсартан, который продемонстрировал большую эффективность в японском исследовании [13].
В исследованиях in vitro показано, что кандесартан отличается наиболее высокой силой связи с рецептором, условно принятой за 1, и самой большой длительностью связи с рецептором. Эти данные согласуются с исследованием in vitro, в котором по аффинности к АТR1 кандесартан превосходил все другие сартаны, что может объяснять длительную, почти необратимую, блокаду рецептора [14]. В отличие от большинства сартанов кандесартан имеет 4 сайта связывания сангиотензиновыми рецепторами (лозартан–2, вальсартан–3), что обеспечивает препарату устойчивость связи с рецептором почти на 100 часов, превосходя по этому показателю олмесартан, телмисартан, ирбесартан, валсартан, лозартан [15]. Такие различия в кинетике взаимодействия с АТ-рецепторами между сартанами в большей степени обусловливают различия в выраженности гипотензивного эффекта, чем другие фармакокинетические параметры (например, период полувыведения – T1/2).
По выраженности антигипертензивного эффекта сартаны, наверное, можно расположить следующим образом: азилсартан, кандесартан, телмисартан, ирбесартан, валсартан, лозартан, эпросартан. Однако следует помнить, что эффект всех этих препаратов – дозозависимый. Поэтому очень важно, титровать дозы до максимально рекомендованных или переносимых.
Сартаны и гипертрофия миокарда левого желудочка
Гипертрофия миокарда левого желудочка (ГЛЖ) в результате хронической перегрузки давлением или объемом является независимым предиктором неблагоприятных исходов у пациентов с АГ. Многочисленные исследования показали, что ГЛЖ увеличивает риск ишемической болезни сердца, ХСН, инсульта или транзиторной ишемической атаки, внезапной смерти и смерти от всех причин. Хотя механизмы развития ГЛЖ полностью не расшифрованы, не вызывает сомнений роль РААС в этом процессе. Сравнивая эффективность различных лекарственных препаратов, применяемых в терапии АГ,
B.M.W. Schmidt и R.E. Schmieder (2005) пришли к заключению, что наиболее эффективными в отношении регресса ГЛЖ являются сартаны (13%). Для сравнения: эффективность иАПФ составила
10%, блокаторов кальциевых каналов – 11%, диуретиков – 8%, блокаторов β-адренорецепторов – 6% [16].
В первую очередь лозартан (LIFE), кандесартана (CATCH) и телмисартана (TRANSCEND) в многоцентровых плацебо-контролируемых клинических исследованиях продемонстрировали уменьшение выраженности ГЛЖ.
Сартаны и фибрилляция предсердий
Фибрилляция предсердий (ФП) – независимый отрицательный прогностический фактор. Современный алгоритм лечения ФП как пароксизмальной, так и персистирующей формы, заключается в назначении терапии, в которую входят блокаторы РААС (иАПФ, сартаны), статины, β-адреноблокаторы. В исследованиях LIFE (лозартан), VALUE (валсартан), CHARM (кандесартан) и TRANSCEND (телмисартан) получено достоверно значимое снижение частоты возникновения новых случаев ФП на 29–44%. Особенно высок риск возникновения ФП при ХСН. Валсартан и кандесартан продемонстрировали способность снижать риск возникновения ФП у больных с тяжелой ХСН.
Сартаны и ХСН
Блокада РААС является важной стратегией лечения пациентов с сердечной недостаточностью, обеспечивая сбалансированное снижение пред- и постнагрузки. Только три сартана в исследованиях доказали улучшение прогноза у лиц с ХСН и сниженной фракцией левого желудочка – лозартан (ELITE II), валсартан (Val-HeFT) и кандесартан (CHARM).
Сартаны и инфаркт миокарда
Одной из важных проблем пациентов, перенесших острый инфаркт миокарда, является раннее развитие сердечной недостаточности. Важную роль в процессе постинфарктного ремоделирования играет РААС. Из группы сартанов только у валсартана есть показание: повышение выживаемости лиц с острым инфарктом миокарда. В первую очередь, это связано с результатами исследования VALIANT, показавшего снижение смертности на 25% у пациентов, перенесших инфаркт миокарда [17]. В то же время доказана эффективность сартанов в первичной и вторичной профилактике инфаркта миокарда у лиц высокого риска (телмисартан в исследованиях ONTARGET, TRANSCEND).
Сартаны и нефропротекция
Сегодня мы хорошо знаем, что любая хроническая кардиальная патология изменяет состояние почки. И ключевое значение в этом патологическом процессе играет гиперактивация РААС и гиперпродукция АТ-II. Сартаны предотвращают негативные эффекты АТ-II, опосредуемые через ATR1 сосудов и надпочечников, независимо от пути его образования – в результате синтеза химаз или АПФ. Применение сартанов было эффективно как на начальных стадиях хронической болезни почек, так и при выраженных нарушениях (исследования RENAAL с лозартаном, IDNT и IRMA-II – сирбесартаном, MARVAL – с валсартаном, CALM – с кандесартаном, DETAIL, INNOVATION – с телмисартаном). Использование этих препаратов приводит к снижению внутриклубочкового давления, торможению пролиферации гладкомышечных клеток сосудов почек, мезангия, развития фиброза в клубочках и, как следствие, уменьшению уровня креатинина и протеинурии.
В 2021 году вышли обновленные клинические рекомендации KDIGO (Kidney Disease: Improving Global Outcomes) «Контроль АД у пациентов с ХБП». В них предлагается новый целевой уровень систолического артериального давления (САД) < 120 мм рт. ст. для взрослых пациентов с АГ и ХБП до диализной стадии. Для достижения этой цели для пациентов с АГ, ХБП и выраженной альбуминурией (С1–С4, A3) и лиц с сахарным диабетом, ХБП и умеренной альбуминурией (С1–С4, A2) рекомендовано назначение блокаторов РААС [18].
При выборе препарата из группы сартанов у кандесартана есть преимущества. Он обладает более выраженным антипротеинурическим эффектом в сравнении с лозартаном. И хотя выраженность антипротеинурического эффекта сравнима с периндоприлом и трандолаприлом, он более стойкий. Терапия кандесартаном сопровождается увеличением скорости клубочковой фильтрации. Кроме того, выступая как антиоксидант, кандесартан подавляет выработку свободных радикалов, защищая клетки почек от повреждения [19].
С другой стороны, важное преимущество валсартана, по данным рандомизированных исследований,– снижение протеинурии независимо от исходного уровня АД [20].
Сартаны и церебропротекция
Доказана эффективность сартанов в первичной и вторичной профилактике цереброваскулярных заболеваний. В исследованиях LIFE, MOSES, SCOPE, JIKEI HEART, KYOTO HEART доказано более выраженное церебропротекторное действие по сравнению с плацебо и даже с другими препаратами первой линии антигипертензивной терапии. Преимущества сартанов хорошо показаны в исследовании SCOPE (The Study on Cognition and Prognosis in the Elderly), в котором оценивалась эффективность терапии кандесартаном со стандартным лечением мягкой и умеренной АГ у пожилых пациентов. Результаты этого исследования показали, что применение кандесартана у данной категории больных не сопровождается ортостатической гипотензией и сочетается с меньшим риском развития фатального и нефатального инсульта по сравнению с другими антигипертензивными препаратами. Кандесартан снижал риск нефатального инсульта на 27,8% и общее количество инсультов на 23,6%. Число новых случаев развития деменции было очень низким для изучаемой возрастной группы, также кандесартан обеспечивал более медленные темпы снижения когнитивной функции [21].
В таблице 2 приведены исследования сартанов, подтвердившие их эффективность в клинических ситуациях [22].
ТАБЛИЦА 2 Клинические исследования, подтвердившие эффективность сартанов
| Показание | Лозартан | Валсартан | Кандесартан | Телмисартан | Ирбесартан | Олмесартан | Эпросартан | Азилсартан |
| АГ | LIFE CORD | Val-Syst VALUE VALISH VART+ |
SCOPE SCAST ACCESS CASE-J |
PRISMA I, II | IDNT | RODMAP Ваll study EUTOPIA MORE Oparil study |
MOSES POWER |
EARLY CONSORT |
| АГ + ГЛЖ | LIFE | CATCH | TRANSCEND | |||||
| Нефропатия | RENAL ROAD |
MARVAL NAVIGATOR |
CORAL | INNOVATION DETAIL VIVALDI AMADEOTRENDY |
IRMA-2 IDNT | RODMAP | ||
| Дисфункция эндотелия |
LIFE | TRENDY | VIOS | |||||
| ХСН (ФВ<40%) | ELITE ELITE II HEAAL |
VAL-HeFT CHARM- Added CHARM- Alternative |
RODMAP | |||||
| ХСН с сохраненной фракцией выброса |
VALUE | CARM- Preserved |
||||||
| Острый инфаркт миокарда |
VALLIANT | |||||||
| Перенесенный инфаркт миокарда |
OPTIMAAL | SCOPE | ||||||
| Острые нарушения мозгового кровообращения |
SCAST | PRoFESS | ACTIVE Ι | |||||
| Первичная профилактика инсульта |
LIFE | ACCESS NAGOYA HEART |
TRANSCEND | MOSES POWER |
||||
| Вторичная профилактика инсульта |
SCOPE | ONTARGET | MOSES | |||||
| Профилактика ФП | LIFE | VALUE | CHARM | TRANSCEND | ||||
| Вторичная профилактика сердечно-сосудистых заболеваний у пациентов высокого риска |
JUKEI-HEART KYOTO HEART |
ONTARGET TRANSCEND |
||||||
| Профилактика диабета (PPAR-γ) |
LIFE | VALUE | CHARM | TRANSCEND |
Переносимость сартанов
Сартаны обладают хорошим профилем безопасности и переносимости. Частота развития нежелательных эффектов примерно соответствует таковой при использовании плацебо и выше, чем у иАПФ. При применении препаратов из данной группы наблюдается самая высокая приверженность к терапии. По данным мета-анализаD. Caldeira и соавт. [23], включавшего 11 рандомизированных клинических исследований и сравнивающих переносимость сартанов, иАПФ, диуретиков и плацебо, частота нежелательных реакций в группе сартанов была сопоставима с плацебо (RR 1,01 (95%CI 0,74–1,39)).
Заключение
Учитывая примерную схожесть антигипертензивной активности сартанов, выбор препарата для пациента должен определяться в каждой конкретной ситуации. Так, для лиц с множественными факторами риска развития сердечно-сосудистых осложнений препарат выбора – телмисартан, при нефропатии – кандесартан, перенесшим острый инфаркт миокарда – валсартан, а при ХСН с низкой фракцией выброса, как и с целью профилактики ФП – лозартан, валсартан и кандесартан. У пациентов с гиперурикемией предпочтение должно отдаваться лозартану, а в неврологической практике – телмисартану, лозартану и кандесартану.
Лидером по производству сартанов в нашей стране является предприятие «Академфарм», которое выпускает сартаны (Телмисартан-НАН, Кандесартан-НАН, Валсартан-НАН и Лозартан-НАН) и их фиксированные комбинации с другими препаратами (Валсамлодин, Ко-варсартан, Лозар Н), что позволяет врачу индивидуально подойти к каждому пациенту и выбрать необходимый препарат с максимально органопротективными свойствами.
ЛИТЕРАТУРА
- Hazel Mae A Abraham, White C.M., White W.B. // Drug Saf. – 2015. – Vol.38, N1. – P.33–54.
- Düsing R. // Ther. Adv. Cardiovasc. Dis. – 2016. – Vol.10, N3. – P.133–150.
- Dahlöf B., Devereux R.B., Kjeldsen S.E., et al. // Lancet. – 2002. – Vol.359 (9311). – P.995–1003.
- Schrader J., Lüders S., Kulschewski A., et al. // Stroke. – 2005. – Vol.36, N6. – P.1218–1226.
- Bakris G.L., Weir M.R., Shanifar S., et al. // Arch. Intern. Med. – 2003. – Vol.163, N13. – P.1555–1565.
- Berl T., Hunsicker L.G., Lewis J.B., et al. // Ann. Intern. Med. – 2003. – Vol.138, N7. – P.542–549.
- Parving H.H., Lehnert H., Bröchner‐Mortensen J., etal. // N. Engl. J. Med. – 2001. – Vol.345, N12. – P.870–878.
- Haller H., Ito S., Izzo J.L.Jr., et al. // N. Engl. J. Med. – 2011. – Vol.364. – P.907–917.
- Yusuf S., Teo K.K., Pogue J., et al. // N. Engl. J. Med. – 2008. – Vol.358. – P.1547–1559.
- Bakris G., Gradman А., Reif М. // J. Clin. Hypertens. – 2001. – Vol.3. – P.16–21.
- Nixon R.M., Muller E., Lowy A., Falvey H. // Int. J. Clin. Pract. – 2009. –Vol.63, N5. – P.766–775.
- Heran B.S., Wong M.M.Y., Heran I.K., Wright J.M.// Cochrane Database Sys. Rev. – 2008. – N4: CD003822.
- Hiromi Rakugi, et al. // Hypertens Res. – 2012. – Vol.35, N5. – P.552–558.
- Michel M.C., Foster C., Brunner H.R., Liu L. // Pharmacol. Rev. – 2013. – N65. – P.809–848.
- Van Liefde I., Vauquelin G. // Mol. Cell. Endocrinol., Elsevier. – 2009. – Vol.302, N2. – P.237.
- Schmidt B.M.W., Schmieder R.E. // Dial. Cardiovasc. Med. – 2005. – Vol.10, N1. –P.33–40.
- Velazquez E. J., Pfeffer M. A., Mc Murray J. V., et al. // Eur. J. Heart Fail. – 2003. – N5. – P.537–544.
- KDIGO 2021 Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease.
- Bilous R., Chaturvedi N., Sjolie A.K., et al. // Ann. Intern. Med. – 2009. – Vol.151, N1. – P.11–20.
- Viberti G., Wheeldon N.M. // Circulation. – 2002. – Vol.106. – P.672–678.
- Lundkvist J., Ekman M., Kartman B., et al. // J. Hum. Hypertens. – 2005. – Vol.19. – Р.569–557.
- Подзолков В.И., Драгомирецкая Н.А. // Кардиология. – 2017. – No7 (10). – С.45–55.
- Caldeira D., David C., Sampaio C. // Am. J. Cardiovasc. Drugs. – 2012. – N12. – P.263–277.



